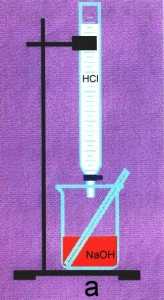
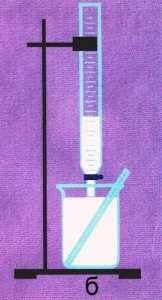
Рис. 8-1. Титрование.
**
§8.5 Индикаторы в реакциях нейтрализации. Титрование.Цвета различных индикаторов в растворах кислот и щелочей приведены в таблице 8-6. С их помощью определяют кислотность или щелочность раствора. Для проявления окраски достаточно добавить в исследуемый раствор всего лишь 1-2 капли 0,1% раствора индикатора.
Таблица 8-6. Окраска индикаторов в растворах щелочей и кислот.
|
Цвет индикатора в растворах: |
|||
|
Название индикатора : |
в кислых |
в нейтральных |
в щелочных |
|
Лакмус Фенолфталеин Метилоранж |
красный бесцветный красный |
фиолетовый бледно-розовый оранжевый |
синий малиновый желтый |
Индикаторы можно условно считать слабыми кислотами, соли которых в растворе имеют иную окраску. Эта окраска не зависит от атома металла, входящего в состав соли. Например, запишем формулу лакмуса в виде "кислоты" НЛ (здесь Н – атом водорода, а Л – часть молекулы лакмуса, имеющей сложное строение). В растворах изменение окраски лакмуса происходит в результате реакции нейтрализации:
|
H Л |
+ |
NaOH |
= |
Na Л |
+ |
H2O |
|
эти молекулы окрашивают раствор в красный цвет |
эти молекулы окрашивают раствор в синий цвет |
А вот как изменяет окраску растворов индикатор фенолфталеин НФ:
|
H Ф |
+ |
NaOH |
= |
Na Ф |
+ |
H2O |
|
эти молекулы бесцветны |
эти молекулы окрашивают раствор в малиновый цвет |
Если после появления малиновой окраски в щелочной раствор фенолфталеина добавить избыток какой-нибудь кислоты, то произойдет обратная реакция и раствор вновь станет бесцветным:
|
Na Ф |
+ |
HCl |
= |
H Ф |
+ |
NaCl |
|
малиновый |
бесцветный |
Однако сначала должна пройти реакция кислоты HCl со щелочью NaOH, добавленной ранее в раствор. До тех пор, пока не прореагирует весь избыток щелочи (сильного основания), кислота не реагирует с индикатором и раствор остается малиновым (т.е. щелочным).
Изменение окраски происходит резко
– как только в растворе не останется NaOH. На этом явлении основано определение неизвестной концентрации раствора какого-нибудь основания или кислоты с помощью добавления раствора кислоты или основания известной концентрации. Такой способ называется титрованием.Титрование проводится с помощью бюретки
– трубки с краником, на которую нанесены деления с точностью до 1/10 мл (см. ниже рис.8-1). В бюретку наливают раствор кислоты или щелочи точно известной концентрации.Например, имеется раствор NaOH неизвестной концентрации. Строго отмеренный объем этого раствора наливают в колбу или стакан и по каплям добавляют к нему из бюретки раствор кислоты, концентрация которого известна. С помощью бюретки точно измеряется объем кислоты, необходимый для полной нейтрализации раствора щелочи неизвестной концентрации. Поскольку точно известна концентрация кислоты, взятой для титрования, то не составляет труда рассчитать концентрацию щелочи.


Рассмотрим конкретный пример. Пусть имеется раствор NaOH неизвестной концентрации. 10,0 мл этого раствора поместили в колбу и добавили 1 каплю слабого раствора фенолфталеина. Раствор окрасился в малиновый цвет (рис. 8-1а).
Малиновый раствор титровали из бюретки с помощью 0,1 М раствора соляной кислоты HCl. Окраска раствора исчезла (рис. 8-1б), когда из бюретки вылилось 16,4 мл кислоты. Какова молярная концентрация раствора NaOH?
Напишем уравнение реакции нейтрализации:
|
NaOH |
+ |
HCl |
= |
NaCl |
+ |
H2O |
|
М моль /л10,0 мл |
0,1 моль/л16,4 мл |
Поскольку реакция идет "моль к молю", мы можем число молей, необходимых для завершения реакции, записать следующим образом (здесь М
– молярная концентрация растворов):(MNaOH)
умножить на (млNaOH) = (MHCl) умножить на (млHCl)или
MNaOH×
10,0 мл = 0,1 моль/л × 16,4 мл.Отсюда:
MNaOH = 0,1× 16,4/10,0 = 0,164 моль/л.Итак, концентрация исследуемого раствора NaOH составляет 0,164 моль/л.
Разумеется, точно так же можно титровать и раствор кислоты неизвестной концентрации специально приготовленным раствором щелочи, концентрация которого нам известна.
Раствор для титрования, концентрация которого известна заранее, иногда называют стандартным раствором. Его объем обозначают
vст. Взятый для титрования объем раствора неизвестной концентрации можно обозначить vx. В общем случае для титрования одноосновных кислот и оснований справедлива формула:M
ст× vст = Mx× vxгде Mст и M
x – молярные концентрации стандартного и исследуемого растворов.Титрование
– распространенная процедура в химической лаборатории.Задачи.
8.14. Какой объем раствора NaOH концентрации 0,1 моль/л потребуется для нейтрализации 20,0 мл раствора HСl концентрации 0,5 моль/л ?
8.15. Для титрования приготовили раствор, в литре которого растворено 40 г NaOH. На титрование 10,0 мл раствора HBr неизвестной концентрации потребовалось 1,6 мл приготовленного раствора щелочи. Какова молярная концентрация раствора HBr?
8.16. Для определения концентрации раствора HCl взяли 2,0 мл этого раствора и титровали его стандартным 0,5М раствором KOH. На титрование израсходовалось 11,2 мл стандартного раствора. Какова концентрация раствора HCl ?
8.17. Предельно допустимая концентрация (ПДК) газообразного HСl в воздухе для человека составляет 5 мг/м
3. В цехе завода по производству хлороводорода пропустили 100 м3 воздуха через 10 л воды. Из полученного раствора отобрали 10 мл и титровали стандартным 0,01 М раствором KOH. На титрование израсходовалось точно 1,15 мл стандартного раствора KOH. Сколько мг газообразного HCl приходится на 1 м3 воздуха в цехе?