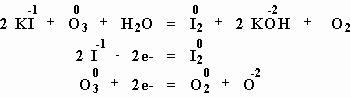
§6.6 Озон.
С озоном вы уже познакомились в главе 1, когда мы рассказывали о составе свежего лесного воздуха (рис. 1-1 - молекула 6). Озон – голубой газ с резким запахом.
Атмосферный озон образуется из кислорода при грозовых разрядах. В лаборатории его также получают при "тихом" (без искр) электрическом разряде сквозь стеклянную трубку, через которую пропускают ток кислорода. Такой прибор называется озонатором. В озонаторе (и в атмосфере во время грозы) происходят следующие реакции:
|
O2 |
= |
2 O |
|
молекула кислорода |
электрический разряд |
атомарный кислород |
O2 + O = O3 (озон)
Очень небольшое содержание озона (7× 10–6 %) в воздухе придает ему запах свежести и благотворно действует на организм человека. Но если содержание озона в атмосфере повысить до 10–4 % (а это совсем мало по сравнению с 21% кислорода в воздухе), то человек испытывает головную боль и другие признаки химического отравления.
Хотя молекулярный кислород и озон составлены из атомов одного и того же элемента кислорода – это разные вещества. С таким же явлением на примере углерода мы уже сталкивались в главе 3 (алмаз и графит). Оно называется аллотропией. Графит и алмаз – разные вещества, хотя и тот и другой состоят только из углерода. Теперь мы наблюдаем такое же явление у кислорода.
Если какой-либо элемент образует два или несколько простых веществ, то такие вещества называются аллотропными модификациями. Само это явление называется аллотропией.
Итак, озон и молекулярный кислород – две разные аллотропные модификации элемента кислорода.
** Озон обладает более сильными окислительными свойствами, чем кислород. Например, озон способен изменить степень окисления иода от -1 до 0 (окислить анион иода до свободного иода), в то время как с кислородом
O2 эта реакция не идет: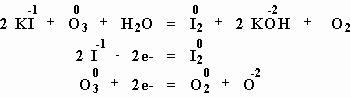
Резина быстро разрушается в атмосфере озона, а спирт при соприкосновении с ним воспламеняется. В чем же причина такой высокой окислительной способности озона?
Молекула озона вполне устойчива, однако на свету или под влиянием катализаторов она легко разлагается с выделением атомарного кислорода:
O3 = O2 + O
Атомарный кислород как окислитель гораздо активнее молекулярного, потому что в молекуле кислорода дефицит электронов на внешнем уровне не так силен из-за объединения электронов в общую "копилку"
– молекулярную орбиталь.Нестабильность озона (при действии света и катализаторов) наряду со способностью убивать бактерии делают его почти идеальным средством для обеззараживания питьевой воды. Озон убивает болезнетворные бактерии окислением, частично превращаясь при этом в молекулярный кислород. Поэтому озонированная вода лучше и вкуснее хлорированной, которую до сих пор приходится пить жителям многих больших городов.
Катализаторами разложения озона могут служить атомарный хлор и другие, самые разнообразные вещества. Много таких веществ среди промышленных выбросов в атмосферу. Эти катализаторы, сами оставаясь неизменными, понижают содержание озона в стратосфере, где он играет роль фильтра для жестких ультрафиолетовых лучей (рис. 6-7).

Рис.
6-7. Озон образуется и разлагается под действием ультрафиолетовых лучей. Молекула озона поглощает ультрафиолетовый свет и рассеивает его энергию в виде тепла. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов. Вспомните также рис. 2-10 из главы 2, где объясняется, почему свет с меньшей длиной волны несет большую энергию и рис. 2-12, показывающий ультрафиолетовую часть солнечного спектра.Стратосфера
– это безоблачная, сухая, холодная область нашей атмосферы приблизительно между 10 и 50 км над уровнем моря. Воздух очень медленно перемешивается в ней по вертикали, но зато довольно интенсивно – по горизонтали. Поэтому промышленные загрязнения, попав в стратосферу, могут оставаться в ней многие годы и легко распространяться вокруг Земли.Озоновый слой, разрушение которого так легко катализируется, очень мал по объему. Если сконцентрировать весь стратосферный озон в окружающую земной шар тонкую оболочку, то ее толщина составит всего около 3 мм. Тем не менее, этого незначительного (в масштабах планеты) количества озона хватает для того, чтобы не пропускать к поверхности Земли наиболее вредные для живых организмов "жесткие" ультрафиолетовые лучи. Когда мы загораем на солнце, на нашу кожу падают "мягкие" ультрафиолетовые лучи, не способные принести вреда здоровью (если загорать в меру).
Таким образом, проблема промышленных выбросов в атмосферу
– это не только проблема загрязнения поверхности Земли вредными веществами, но еще и проблема "загрязнения" солнечного спектра жестким, вредным для человека ультрафиолетовым излучением.Но не стоит и преувеличивать опасность: полное исчезновение озона не грозит атмосфере до тех пор, пока в ней есть кислород и пока светит Солнце.
