§5.1 Химические реакции. Уравнения химических реакций
Химическая реакция - это превращение одних веществ в другие. Впрочем, такое определение нуждается в одном существенном дополнении. В ядерном реакторе или в ускорителе тоже одни вещества превращаются в другие, но такие превращения химическими не называют. В чем же здесь дело?
В ядерном реакторе происходят ядерные реакции. Они заключаются в том, что ядра элементов при столкновении с частицами высокой энергии (ими могут быть нейтроны, протоны и ядра иных элементов) - разбиваются на осколки, представляющие собой ядра других элементов. Возможно и слияние ядер между собой. Эти новые ядра затем получают электроны из окружающей среды и, таким образом, завершается образование двух или нескольких новых веществ. Все эти вещества являются какими-либо элементами Периодической системы. Примеры ядерных реакций, используемых для открытия новых элементов, приведены в §4.4.
В отличие от ядерных реакций, в химических реакциях не затрагиваются ядра атомов. Все изменения происходят только во внешних электронных оболочках. Разрываются одни химические связи и образуются другие.
Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества - с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
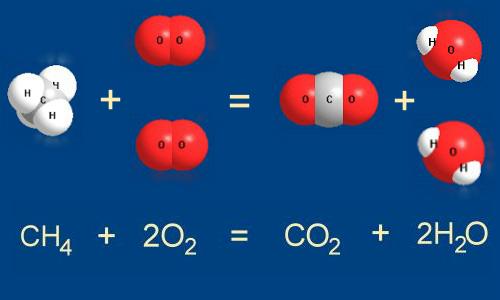
Рассмотрим типичную химическую реакцию: сгорание природного газа (метана) в кислороде воздуха. Те из вас, у кого дома есть газовая плита, могут ежедневно наблюдать эту реакцию у себя на кухне. Запишем реакцию так, как показано на рис. 5-1.

Рис. 5-1. Метан СН
4 и кислород О2 реагируют между собой с образованием диоксида углерода СО2 и воды Н2О. При этом разрываются связи между атомами С и Н в молекуле метана и между атомами кислорода в молекуле О2. На их месте возникают новые связи между атомами С и О, Н и О. На рисунке хорошо видно, что для успешного осуществления реакции на одну молекулу метана надо взять две молекулы кислорода.Записывать химическую реакцию с помощью рисунков молекул не слишком удобно. Поэтому для записи химических реакций используют сокращенные формулы веществ - как это показано в нижней части рис. 5-1. Такая запись называется уравнением химической реакции
.Количество атомов разных элементов в левой и правой частях уравнения одинаково. В левой части один атом углерода в составе молекулы метана (СН
4), и в правой - тот же атом углерода мы находим в составе молекулы СО2. все четыре водородных атома из левой части уравнения мы обязательно найдем и в правой - в составе молекул воды.В уравнении химической реакции для выравнивания количества одинаковых атомов в разных частях уравнения используются коэффициенты, которые записываются перед формулами веществ. Коэффициенты не надо путать с индексами в химических формулах.
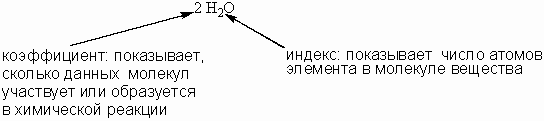
Рассмотрим другую реакцию - превращение оксида кальция СаО (негашеной извести) в гидроксид кальция Са(ОН)
2 (гашеную известь) под действием воды.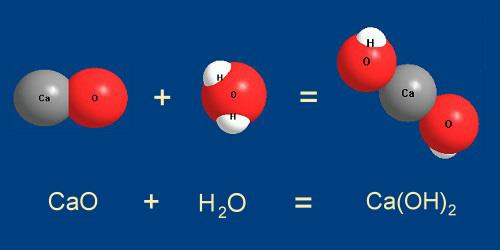
Рис. 5-2. Оксид кальция СаО присоединяет молекулу воды Н2О с образованием
гидроксида кальция Са(ОН)2.
В отличие от математических уравнений, в уравнениях химических реакций нельзя переставлять левую и правую части. Вещества в левой части уравнения химической реакции называются реагентами, а в правой - продуктами реакции. Если сделать перестановку левой и правой части в уравнении из рис. 5-2, то мы получим уравнение совсем другой химической реакции:
Ca(OH)2 = CaO + H2O
Если реакция между СаО и Н
2О (рис. 5-2) начинается самопроизвольно и идет с выделением большого количества теплоты, то для проведения последней реакции, где реагентом служит Са(ОН)2, требуется сильное нагревание.Добавим также, что реагентами и продуктами могут быть не обязательно молекулы, но и атомы - если в реакции участвует какой-нибудь элемент или элементы в чистом виде. Например:
H2 + CuO = Cu + H2O
Существует несколько способов классификации химических реакций, из которых мы рассмотрим два способа.
По первому из них все химические реакции различают по признаку изменения числа исходных и конечных веществ. Здесь можно найти 4 типа химических реакций:
- реакции СОЕДИНЕНИЯ
,- реакции РАЗЛОЖЕНИЯ
,- реакции ОБМЕНА
,- реакции ЗАМЕЩЕНИЯ
.Приведем конкретные примеры таких реакций. Для этого вернемся к уравнениям получения гашеной извести и уравнению получения негашеной извести:
СаО + Н
2О = Са(ОН)2Са(ОН)
2 = СаО + Н2ОЭти реакции относятся к разным типам химических реакций. Первая реакция является типичной реакцией соединения, поскольку при ее протекании две молекулы реагентов СаО и Н
2О соединяются в одну, более сложную молекулу Са(ОН)2.Вторая реакция Са(ОН)
2 = СаО + Н2О является типичной реакцией разложения: здесь реагент Ca(OH)2 разлагается с образованием двух других, более простых веществ (продуктов реакции).В реакциях обмена количество реагентов и продуктов обычно одинаково. В таких реакциях исходные вещества обмениваются между собой атомами и даже целыми составными частями своих молекул. Например, при сливании раствора CaBr
2 с раствором HF выпадает осадок. Происходит реакция, в которой ионы кальция и водорода обмениваются между собой ионами брома и фтора:CaBr2 + 2HF = CaF2¯ + 2HBr
При сливании растворов CaCl
2 и Na2CO3 тоже выпадает осадок, потому что ионы кальция и натрия обмениваются между собой частицами CO32- и Cl– .CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl
Стрелка рядом с продуктом реакции показывает, что это соединение нерастворимо и выпадает в осадок. Таким образом, стрелку можно использовать и для обозначения удаления какого-нибудь продукта из химической реакции в виде осадка (¯ ) или газа ( ). Например:
Zn + 2HCl = H2 + ZnCl2
Последняя реакция относится к еще одному типу химических реакций - реакциям замещения. Цинк заместил водород в его соединении с хлором - в HCl. Водород при этом выделяется в виде газа.
Реакции замещения внешне могут быть похожи на реакции обмена. Отличие заключается в том, что в реакциях замещения обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе. Например:
2NaBr + Cl2 = 2NaCl + Br2 - реакция замещения;
в левой части уравнения есть простое вещество-молекула хлора
Cl2, и в правой части есть простое вещество – молекула брома Br2.В реакциях обмена и реагенты и продукты являются сложными веществами. Например:
CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl - реакция обмена;
в этом уравнении реагенты и продукты - сложные вещества.
Деление всех химических реакций на реакции соединения, разложения, замещения и обмена - не единственное. Есть другой способ классификации: по признаку изменения (или отсутствия изменения) степеней окисления у реагентов и продуктов. По этому признаку все реакции делятся на окислительно-восстановительные реакции и все прочие (не окислительно-восстановительные).
Реакция между Zn и HCl является не только реакцией замещения, но и окислительно-восстановительной реакцией, потому что в ней изменяются степени окисления реагирующих веществ:
Zn0 + 2H+1Cl = H20 + Zn+2Cl2 - реакция замещения и одновременно окислительно-восстановительная реакция.
Окислительно-восстановительными являются также реакции метана с кислородом (рис. 5-1), реакция оксида меди с водородом, реакция бромида натрия с хлором.
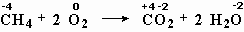
меняют степень окисления углерод и кислород,
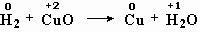
меняют степень окисления водород и медь,
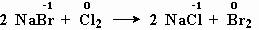
меняют степень окисления бром и хлор.
А вот все остальные реакции, рассмотренные в этом параграфе, окислительно-восстановительными не являются, потому что в них не изменяются степени окисления атомов ни в реагентах, ни в продуктах.
Задачи.
5.1. На месте знаков “?” правильно заполните пропуски в уравнениях химических реакций:
Ca + 2HCl = Ca”?” + H2
2Mg + “?” = 2MgO
2H2”?” + 3O2 = 2H2O + 2SO2
Fe2O3 + 3H2 = 2Fe + 3”?”O
CaCl2 + 2NaOH = Ca(OH)2 + 2Na”?”
5.2. Приведены 8 разных химических реакций. а) Найдите среди них реакции соединения, разложения, замещения и обмена. Запишите их уравнения в 4 столбика (по две реакции каждого типа в столбике); б) Уравняйте реакции; в) Подчеркните те реакции, которые являются окислительно-восстановительными. Укажите в них степени окисления атомов в реагентах и продуктах:
H2 + O2 = H2O (реакция идет со взрывом)
Zn + CuCl2 = Cu + ZnCl2 (реакция происходит в растворе)
NH3 = N2 + H2 (реакция идет при нагревании в газовой фазе)
Cu + S = CuS (реакция идет при нагревании порошков Cu и S)
AgF + NaCl = AgCl¯ + NaF (реакция происходит в растворе)
CaCO3 = CaO + CO2 (реакция происходит при нагревании)
CuBr2 + NaOH = Cu(OH)2¯ + NaBr (реакция происходит в растворе)
Fe + H2O = H2 + Fe2O3 (реакция происходит при нагревании)
