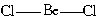
**§3.6 Пространственная форма молекул.
Формулы Льюиса многое говорят об электронном строении и устойчивости молекул, но почти ничего не могут сказать об их пространственном строении. В теории химической связи существуют два хороших подхода к объяснению и предсказанию геометрии молекул. Они хорошо согласуются между собой.
Первый подход называется теорией отталкивания валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого подхода очень проста и понятна:
химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
Поясним на конкретных примерах. В молекуле BeCl2 есть две связи Be—Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:
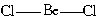
Это возможно только при линейной форме молекулы, когда угол между связями равен 180о (угол ClBeCl = 180
o).Другой пример: в молекуле BF
3 имеется 3 связи B—F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями равны 120о (угол FBF = 120o):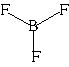
Еще один пример: в молекуле CH
4 имеется 4 связи C—H. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в плоском квадрате расстояния между связями C—H меньше, чем в тетраэдре, поэтому реальная молекула CH4 тетраэдрическая, а не плоская: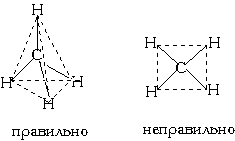
В тетраэдре угол между связями составляет 109о
28’ (угол HCH = 109o 28’). Именно такой угол наблюдается в молекуле CH4 по данным рентгеноструктурного анализа.Последний пример: молекула H
2O в своем составе имеет 2 связи O—H и 2 неподеленные пары электронов. Вывод: эта молекула также должна иметь форму, похожую на тетраэдр.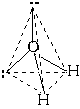
Реально этот тетраэдр слегка искажен, потому что неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга. Поэтому реальный угол HOH составляет не 109о, а немногим менее 105о
.Если ввести обозначения: н.п - неподеленная пара, п.п - поделенная пара, то относительное отталкивание между ними дает такой ряд:
(н.п/н.п) > (н.п/п.п) > (п.п/п.п).
Теория отталкивания валентных электронных пар (ОВЭП) проста и наглядна. Она опирается на классическую геометрию и позволяет правильно предсказывать форму молекул.
Однако образование одинаковых связей из атомных орбиталей разного вида потребовало введения такого понятия, как ГИБРИДИЗАЦИЯ
(то есть “смешивание”) атомных орбиталей. Почему это понятие стало необходимо?Вернемся к уже знакомой нам молекуле BeCl
2. Ее образование вполне понятно из электронного строения атомов бериллия и хлора, которое изображается формулами Льюиса: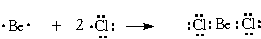
Электронная конфигурация валентной оболочки бериллия 2s
2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние: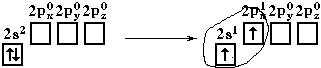
Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2p
x-электрона бериллия, то связи Be-Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180°.Чтобы объяснить равноценность связей Be—Cl, говорят о
sp-гибридизации валентных атомных орбиталей бериллия, при которой одна s-орбиталь и одна p-орбиталь (они обведены на орбитальной диаграмме) как бы смешиваются и выравниваются по форме и энергии, давая две одинаковые sp-гибридные орбитали (рис. 3-7).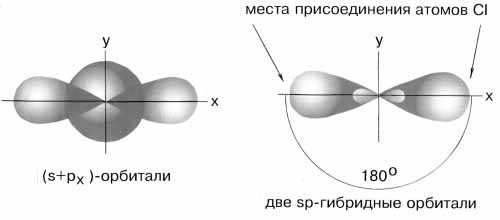
Рис. 3-7. sp-гибридизация валентных орбиталей бериллия в соединении BeCl
2. Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия лежат на одной прямой.Считается, что благодаря sp-гибридизации молекула BeCl
2 имеет линейную форму и все три ее атома находятся на одной прямой, а обе связи Be-Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы.Если валентная оболочка атома включает электроны на одной s-орбитали и двух p-орбиталях, имеет место sp
2-гибридизация, дающая несколько иную геометрию молекулы. Примером может служить sp2-гибридизация бора при образовании молекулы BF3 (рис. 3-8). На орбитальной диаграмме обведены одна s и две p-орбитали, которые “смешиваются”, то есть гибридизуются.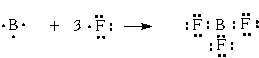
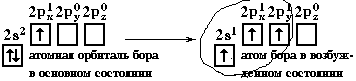
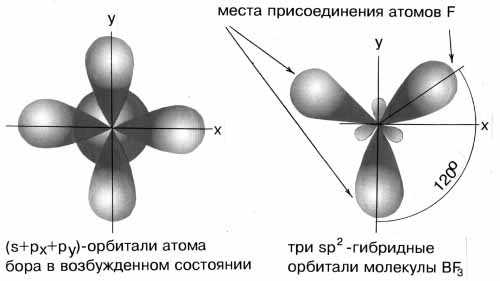
Рис.3-8. sp
2-гибридизация валентных орбиталей бора в соединении BF3. Три sp2-гибридные орбитали бора лежат в одной плоскости под углом 120°.Наконец, когда смешиваются одна s- и три p-орбитали, возникают sp
3-гибридизованные молекулы, имеющие геометрию тетраэдра (рис. 3-9). Примером может служить соединение углерода с водородом СН4 (метан).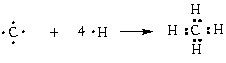
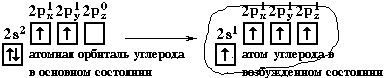
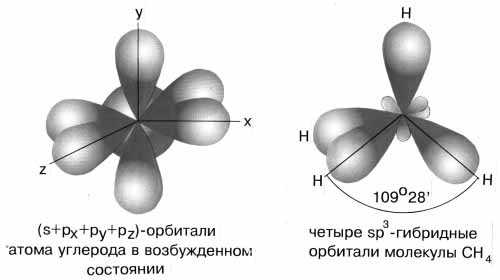
Рис. 3-9. sp
3-гибридизация валентных орбиталей углерода. Четыре sp3-гибридные орбитали углерода направлены в вершины правильного тетраэдра. Атом углерода находится в центре тетраэдра. Углы между всеми связями равны и составляют 109°28'.Существует важное правило:
При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
Если все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не отличаются друг от друга. В других случаях встречаются небольшие отклонения от стандартных валентных углов. Например, в молекуле воды H
2O кислород - sp3-гибридный, находится в центре неправильного тетраэдра, в вершины которого "смотрят" два атома водорода и две неподеленные пары электронов (рис. 3-10а). Валентный угол HОН составляет 105°, что довольно близко к теоретическому значению 109° .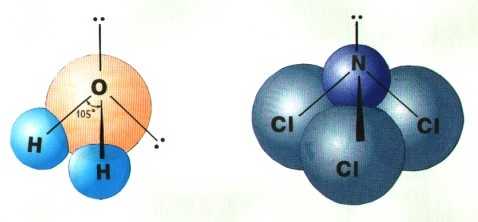
Рис. 3-10. sp
3-гибридизация в молекулах а) H2O и б) NCl3.Если бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно, совершенно по-другому. Почему? На этот вопрос вы сможете ответить сами, когда прочтете о молекуле H
2O в отдельной главе, посвященной воде и растворам.Задачи.
3.18. На рис. 3-10(б) изображена sp
3-гибридная молекула NСl3. Нарисуйте орбитальную диаграмму азота, укажите на ней гибридизующиеся орбитали. Напишите взаимодействие атома азота и трех атомов хлора с помощью структур Льюиса.3.19. Хлорид алюминия AlCl
3 в реакции с хлорид-ионом Cl– образует анион AlCl4–. Определите вид гибридизации орбиталей алюминия в обоих частицах. Предскажите геометрическую форму обоих частиц на основании теории ОВЭП и теории гибридизации.3.20. На основании теории ОВЭП предскажите, каким будет угол Ð ClNCl в молекуле NСl
3 (рис. 3-10б): больше или меньше 109о?3.21. В молекуле NCl
3 атом азота имеет sp3-гибридизацию. А какова, по вашему мнению, гибридизация атомов хлора в этой молекуле?3.22. На основании теории ОВЭП изобразите геометрическую форму аниона SbF
6- . Примечание: в решении этой задачи вам потребуется знание геометрии.3.23. Определите гибридизацию центрального атома в молекулах: а) BH
3, б) BeH2, в) PH3.3.24 (НГУ). Для алюминия известны соединения с анионом состава AlF63- , тогда как бор образует с фтором только анион состава BF4- . Объясните этот факт. Укажите гибридизацию атомных орбиталей металла в указанных анионах и их пространственное строение.
