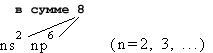
§3.1 Разновидности химических связей.
Стремление к состоянию с наименьшей энергией является общим свойством материи. Вы наверняка знаете о горных снежных лавинах и камнепадах. Их энергия настолько велика, что может сметать с лица земли мосты, дома и другие крупные и прочные сооружения. Причина этого грозного явления природы в том, что масса снега или камней стремится занять состояние с наименьшей энергией, а потенциальная энергия физического тела у подножья горы меньше, чем на склоне или вершине.
Атомы образуют между собой связи по той же причине: суммарная энергия соединившихся атомов меньше, чем энергия тех же атомов в свободном состоянии. Это очень счастливое для нас с вами обстоятельство - ведь если бы при соединении атомов в молекулы не происходил выигрыш в энергии, то Вселенную заполняли бы только атомы элементов, а появление простых и сложных молекул, необходимых для существования жизни, было бы невозможно.
Однако, атомы не могут связываться друг с другом произвольно. Каждый атом способен связываться с конкретным количеством других атомов, причем связанные атомы располагаются в пространстве строго определенным образом. Причину этих ограничений следует искать в свойствах электронных оболочек атомов, а точнее - в свойствах внешних электронных оболочек, которыми атомы взаимодействуют друг с другом.
Завершенная внешняя электронная оболочка обладает меньшей (т.е. более выгодной для атома) энергией, чем незавершенная. По правилу октета завершенная оболочка содержит 8 электронов:
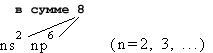
Таковы внешние электронные оболочки атомов благородных газов, за исключением гелия
(n = 1), у которого завершенная оболочка состоит из двух s-электронов (1s2) просто потому, что p-подуровня на 1-м уровне нет.Внешние оболочки всех элементов, кроме благородных газов, являются НЕЗАВЕРШЕННЫМИ и в процессе химического взаимодействия они ЗАВЕРШАЮТСЯ.
Химическая связь образуется за счет электронов внешних электронных оболочек, но осуществляется она по-разному. Различают три основных типа химической связи:
ковалентную связь и ее разновидность полярную ковалентную связь,
ионную связь
металлическую связь.
Давайте, начиная со следующего параграфа, последовательно разберемся в этих видах химической связи.
